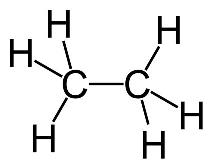
Структурная формула
 |
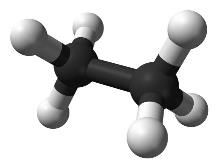 |
Истинная, эмпирическая, или брутто-формула: C2H6
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| C | Углерод | 12,011 | 2 | 79,9% |
| H | Водород | 1,008 | 6 | 20,1% |
Молекулярная масса: 30,07
Этан (лат. Ethanum), C2H6 — органическое соединение, второй член гомологического ряда алканов. В природе содержится в составе природного газа, нефти и других углеводородах. По сравнению с метаном и пропаном более пожаро- и взрывоопасен. Малотоксичен. Обладает наркотическим действием, которое ослабляется ничтожной растворимостью в воде и крови. Класс опасности — четвёртый.
Свойства
Физические свойства
Этан при н. у. — бесцветный газ, без запаха и вкуса. Молярная масса — 30,07. Температура плавления −182,81 °C, кипения −88,63 °C. Плотность ρгаз.=0,001342 г/см³ или 1,342 кг/м³ (н. у.), ρжидк.=0,561 г/см³ (T=-100 °C). Давление паров при 0 °С — 2,379 МПа. Нерастворим в воде.
Химические свойства
Химическая формула C2H6 (рациональная СН3СН3). Наиболее характерны реакции замещения водорода галогенами, проходящие по свободно радикальному механизму. Термическое дегидрирование этана при 550—650 °С приводит к этилену, при температурах свыше 800 °С — к ацетилену (образуются также бензол и сажа). Прямое хлорирование при 300—450 °С — к этилхлориду, нитрование в газовой фазе дает смесь (3:1) нитроэтана и нитрометана.
Физиологическое действие
Обладает слабым наркотическим и галлюциногенным действием (ослаблено за счет низкой растворимости в жидкостях организма).
Получение
В промышленности
В промышленности получают из нефтяных и природных газов, где он составляет до 10 % по объёму. В России содержание этана в нефтяных газах очень низкое. В США и Канаде (где его содержание в нефтяных и природных газах высоко) служит основным сырьём для получения этилена.
В лабораторных условиях
Получают из иодметана по реакции Вюрца, из ацетата натрия электролизом по реакции Кольбе, сплавлением пропионата натрия с щелочью, из этилбромида по реакции Гриньяра, гидрированием этилена (над Pd) или ацетилена (в присутствии никеля Ренея).
Применение
Основное использование этана в промышленности — получение этилена.
Интересные факты
Предположительно, на поверхности Титана (спутник Сатурна) в условиях низких температур (−180 °C) существуют целые озёра и реки из жидкой метано-этановой смеси.
