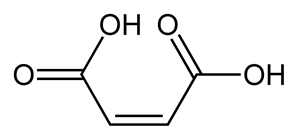
Структурная формула
 |
 |
Истинная, эмпирическая, или брутто-формула: C4H4O4
Химический состав Малеиновой кислоты
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| C | Углерод | 12,011 | 4 | 41,4% |
| H | Водород | 1,008 | 4 | 3,5% |
| O | Кислород | 15,999 | 4 | 55,1% |
Молекулярная масса: 116,072
Малеиновая кислота - органическое соединение с формулой HOOC-CH=CH-COOH. Название по номенклатуре IUPAC — цис-бутендиовая кислота. Её транс-изомером является фумаровая кислота. Наиболее часто она используется для получения фумаровой кислоты.
Физические свойства
Молекула малеиновой кислоты менее стабильна чем фумаровой кислоты. Разница их теплот сгорания равна 22,7 кДж/моль. Также малеиновая кислота хорошо растворима в воде (78,8 г/л при 25 °C), а фумаровая кислота — плохо (6,3 г/л при 25 °C). Оба свойства объясняются образованием внутримолекулярных водородных связей в молекуле малеиновой кислоты.
История и методы синтеза
Малеиновая кислота впервые была получена Лассэнем в 1819 г. перегонкой яблочной кислоты. По Перкину (1881 г.), для её получения яблочную кислоту обрабатывают ацетилхлоридом, получая ацетил-яблочный ангидрид, который разлагается с образованием уксусной кислоты и малеинового ангидрида, гидратацией которого получают малеиновую кислоту.
Производство в промышленности
В промышленности малеиновою кислоту получают гидролизом малеинового ангидрида, который получают каталитическим окислением бензола
Применение в промышленности
Наиболее важным применением малеиновой кислоты является использование её в производстве фумаровой кислоты. Для производства фумаровой кислоты малеиновою кислоту каталитически (катализаторы — тиомочевина, неорганические кислоты) изомеризуют. Очень малая растворимость фумаровой кислоты сильно упрощает её отделение от непрореагировавшей малеиновой кислоты. Хотя обе кислоты являются конформерами, они не могут самопроизвольно превращаться одна в другую. Это объясняется тем, что для их взаимопревращение нужно разорвать двойную углерод-углеродную связь, что не является энергетически выгодным. Путём озонолиза малеиновою кислоту превращают в глиоксиловою кислоту.
Другие реакции
Малеиновою кислоту можно превратить в яблочную кислоту путём гидратации, в янтарную кислоту путём гидрирования, в малеиновый ангидрид путём дегидратации. Вышеперечисленные реакции не используются в промышленности, потому что они являются экономически невыгодными.
