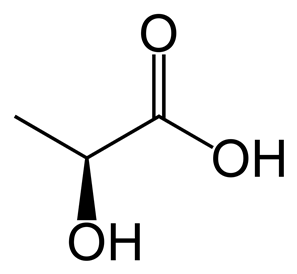
Структурная формула
 |
 |
Истинная, эмпирическая, или брутто-формула: C3H6O3
Химический состав Молочной кислоты
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| C | Углерод | 12,011 | 3 | 40% |
| H | Водород | 1,008 | 6 | 6,7% |
| O | Кислород | 15,999 | 3 | 53,3% |
Молекулярная масса: 90,078
Молочная кислота (лактат) — α-оксипропионовая (2-гидроксипропановая) кислота.
- tпл 25—26 °C оптически активная (+)- или (-)-форма.
- tпл 18 °C рацемическая форма.
Молочная кислота образуется при молочнокислом брожении сахаров, в частности, в прокисшем молоке, при брожении вина и пива.
Была открыта шведским химиком Карлом Шееле в 1780 году.
В 1807 году Йенс Якоб Берцелиус выделил из мышц цинковую соль молочной кислоты.
Молочная кислота в организме человека и животных
Молочная кислота формируется при распаде глюкозы. Иногда называемая «кровяным сахаром», глюкоза является главным источником углеводов в нашем организме. Это основное топливо для мозга и нервной системы, так же как и для мышц во время физической нагрузки. Когда расщепляется глюкоза, клетки производят АТФ (аденозинтрифосфат), который обеспечивает энергией большинство химических реакций в организме. Уровень АТФ определяет, как быстро и как долго наши мышцы смогут сокращаться при физической нагрузке.
Производство молочной кислоты не требует присутствия кислорода, поэтому этот процесс часто называют «анаэробным метаболизмом» (см. Анаэробная тренировка). Ранее считалось, что мышцы производят молочную кислоту, когда недополучают кислород из крови. Другими словами, вы находитесь в анаэробном состоянии. Однако современные исследования показывают, что молочная кислота образуется и в мышцах, получающих достаточно кислорода. Увеличение количества молочной кислоты в кровотоке свидетельствует лишь о том, что уровень её поступления превышает уровень удаления. Резкое увеличение (в 2—3 раза) уровня лактата в сыворотке крови наблюдается при тяжёлых расстройствах кровообращения, таких как геморрагический шок, острая левожелудочковая недостаточность и др., когда одновременно страдает и поступление кислорода в ткани и печеночный кровоток.
Зависимое от лактата производство АТФ очень незначительно, но имеет большую скорость. Это обстоятельство делает идеальным его использование в качестве топлива, когда нагрузка превышает 50 % от максимальной. При отдыхе и умеренной нагрузке организм предпочитает расщеплять жиры для получения энергии. При нагрузках в 50 % от максимума (порог интенсивности для большинства тренировочных программ) организм перестраивается на преимущественное потребление углеводов. Чем больше углеводов вы используете в качестве топлива, тем больше производство молочной кислоты.
Исследования показали, что у престарелых людей в головном мозге количество солей кислоты (лактатов) имеет повышенный уровень.
Регулятор обмена
Чтобы глюкоза могла проходить через клеточные мембраны, ей необходим инсулин. Молекула же молочной кислоты в два раза меньше молекулы глюкозы, и гормональная поддержка ей не нужна — она с лёгкостью сама проходит через клеточные мембраны.
Качественные реакции
Молочную кислоту можно обнаружить по следующим качественным реакциям:
- Взаимодействие с n-оксидифенилом и серной кислотой:
При осторожном нагревании молочной кислоты с концентрированной серной кислотой она вначале образует уксусный альдегид и муравьиную кислоту; последняя немедленно разлагается: CH3CH(OH)COOH → CH3CHO + HCOOH (→ H2O + CO) Уксусный альдегид взаимодействует с n-оксидифенилом, причём, по-видимому, происходит конденсация в o-положении к OH-группе с образованием 1,1-ди(оксидифенил)этана. В растворе серной кислоты медленно окисляется в фиолетовый продукт неизвестного состава. Поэтому, как и при обнаружении гликолевой кислоты с помощью 2,7-диоксинафталина, в данном случае происходит взаимодействие альдегида с фенолом, при котором концентрированная серная кислота действует как конденсирующий агент и окислитель. Такую же цветную реакцию дают α-оксимасляная и пировиноградная кислоты.
Выполнение реакции: В сухой пробирке нагревают в течение 2 минут на водяной бане при 85 °C каплю исследуемого раствора с 1 мл концентрированной серной кислоты. После этого охлаждают под краном до 28 °C, добавляют небольшое количество твёрдого n-оксидифенила и, перемешав несколько раз, дают постоять 10-30 минут. Фиолетовое окрашивание появляется постепенно и через некоторое время становится более глубоким. Открываемый минимум: 1,5·10−6 г молочной кислоты.
- Взаимодействие с подкисленным серной кислотой раствором перманганата калия
Выполнение реакции: В пробирку прилить 1 мл молочной кислоты, а затем немного подкисленного серной кислотой раствора перманганата калия. Нагревать в течение 2 минут на слабом огне. Ощущается запах уксусной кислоты. С3Н6О3 + [O] = C3Н4O3 + H2O↑ Продуктом данной реакции может быть пировиноградная кислота С3Н4О3, которая тоже имеет запах уксусной кислоты. С3Н6О3 + [O] = C3Н4O3 + H2O↑ Однако пировиноградная кислота при обычных условиях неустойчива и быстро окисляется до уксусной кислоты, поэтому реакция протекает согласно суммарному уравнению: С3Н6О3 + 2[O] = CH3COOH + CO2↑ + H2O
Применение и получение
В пищевой промышленности используется как консервант, пищевая добавка E270.
Поликонденсацией молочной кислоты получают пластик PLA.
Получают молочную кислоту молочнокислым брожением глюкозы (ферментативная реакция):
C6H12O6 → 2CH3CH(OH)COOH + 21,8·104 Дж
