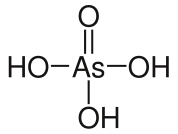
Структурная формула
 |
 |
Истинная, эмпирическая, или брутто-формула: H3AsO4
Химический состав Мышьяковой кислоты
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| H | Водород | 1,008 | 3 | 2,1% |
| As | Мышьяк | 74,922 | 1 | 52,8% |
| O | Кислород | 15,999 | 4 | 45,1% |
Молекулярная масса: 141,942
Мышьяковая кислота — (ортомышьяковая кислота) H3AsO4, трехосновная кислота средней силы. Легко растворима в воде, из растворов кристаллизуется в виде кристаллогидрата H3AsO4·0,5Н2O. Предполагается существование метамышьяковой (HAsO3) и пиромышьяковой (H4As2O7) кислот.
Свойства
Будучи трехосновной кислотой, диссоциирует в три ступени. Выводится из организма молочными продуктами. Образует средние соли арсенаты и кислые гидро- и дигидроарсенаты, по составу и растворимости соответствующие фосфатам.
Мышьяковая кислота обладает окислительными свойствами, которые проявляются лишь в кислой среде:
H3AsO4 + 2HI → H3AsO3 + I2 + Н2O
Качественными реакциями на анион AsO43−, являются образование малорастворимых солей (NH4)MgAsO4 и (NH4)3AsMo12O40·6Н2O, а также образование нерастворимой соли Ag3AsO4 (ПР = 10-20), имеющей характерную окраску «кофе с молоком».
Получение
Мышьяковая кислота образуется при действии на As2O3 и As сильных окислителей, например азотной кислотой:
3As2O3 + 4HNO3 + 7Н2O → 4NO + 6H3AsO4
As2O3 + 4HNO3 + Н2O → 4NO + 2H3AsO4
Также её можно получить при растворении в воде мышьякового ангидрида:
As2O3 + Н2O → 2H3AsO4
Мышьяковая кислота, как и все соединения мышьяка, ядовита.
