Структурная формула
 |
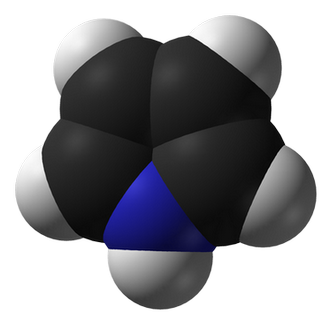 |
Истинная, эмпирическая, или брутто-формула: C4H5N
Химический состав Пиррола
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| C | Углерод | 12,011 | 4 | 71,6% |
| H | Водород | 1.008 | 5 | 7,5% |
| N | Азот | 14,007 | 1 | 20,9% |
Молекулярная масса: 67,091
Пиррол — ароматический пятичленный азотистый гетероцикл, обладает слабыми кислотными свойствами. Содержится в костном масле (которое получают при сухой перегонке костей), а также в каменноугольной смоле. Пиррольные кольца входят в состав порфиринов — хлорофилла растений, гема гемоглобинов и цитохромов и ряда других биологически важных соединений.
Строение и свойства
Пиррол представляет собой бесцветную жидкость, напоминающую по запаху хлороформ, медленно темнеющую при стоянии на воздухе. Он слегка гигроскопичен, немного растворим в воде и хорошо растворим в большинстве органических растворителей. Структуру пиррола предложил в 1870 г. Байер, основываясь на его окислении хромовой кислотой в малеинимид и образовании его при перегонке сукцинимида с цинковой пылью.
Кислотность и металлирование
Пиррол является слабой NH-кислотой (pKa 17,5 в воде) и реагирует со щелочными металлами и их амидами в жидком аммиаке или инертных растворителях с депротонированием по положению 1 и образованием соответствующих солей. Аналогично проходит и реакция с реактивами Гриньяра, при которой образуются N-магниевые соли. N-замещённые пирролы реагируют с бутил- и фениллитием, металлируясь в α-положение.
Электрофильное замещение
Пиррол является электронообогащённой ароматической системой (π-избыточным гетероциклом), в которой ароматический секстет электронов распределяется по пяти атомам цикла. Вследствие этого проявляет сильные нуклеофильные свойства: для него характерны реакции электрофильного замещения, идущие преимущественно по α-положениям. Пиррол чувствителен к сильным кислотам: его протонирование ведёт к потере ароматичности, образующийся при этом протонированный катион атакует нейтральные молекулы пиррола, что ведёт к полимеризации с образованием смолистых продуктов, окрашенных в красный цвет (т. н. пиррол-красный). Нитрование и сульфирование вследствие чувствительности пиррола к кислотам проводят нейтральными агентами — ацетилнитратом (образуется преимущественно 2-нитропиррол с примесью 3-нитропроизводного) и комплексом серный ангидрид-пиридин (образуется 2-пирролсульфокислота). Пиррол галогенируется в мягких условиях, образуя тертрагалогенпирролы и вступает с солями диазония в реакцию диазосочетания, образуя в слабокислой и нейтральной среде 2-азопроизводные, а в щелочной — бис-2,5-диазопроизводные. Незамещённый пиррол реагирует с углеродными электрофилами, образуя продукты замещения. Так, пиррол ацилируется уксусным ангидридом при 100 °C, образуя смесь 2-ацетил- и 2,5-диацетилпирролов; формилируется по положению 2 по Вильсмейеру-Хааку (диметилформамид и POCl3) и Раймеру-Тиману (хлороформ и NaOH); в реакции Манниха (формальдегид и диалкиламины) образует 2-диалкиламинопирролы; реагирует с активированными карбонильной или нитрильной группой алкенами (акрилаты, малеиновый ангидрид, акрилонитрил) по типу присоединения по Михаэлю, образуя продукты алкилирования по α-положениям. Активированными алкилгалогениды (аллил- и бензилгалогениды) в присутствии слабых оснований пиррол алкилируется по α-положениям, йодистым метилом в жестких условиях 100—150°C — также и в положения 3 и 4. Пиррол является настолько сильным нуклеофилом, что реагирует даже с таким слабым электрофилом, как CO2, карбоксилируясь при нагревании под давлением с водным раствором карбоната аммония с образованием аммониевой соли пиррол-2-карбоновой кислоты.
Методы синтеза
Замещённые пирролы синтезируются по Паалю-Кнорру реакцией 1,4-дикетонов с аммиаком или первичными аминами. Исторически наиболее значимый лабораторный синтез пиррола — пиролиз аммониевой соли слизевой кислоты (легко получаемой окислением галактозы), этот синтез представляет собой вариант синтеза Пааля-Кнорра.
.