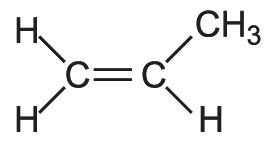
Структурная формула
 |
 |
Истинная, эмпирическая, или брутто-формула: C3H6
Химический состав Пропилена
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| H | Водород | 1.008 | 6 | 14,4% |
| С | Углерод | 12.011 | 3 | 85,6% |
Молекулярная масса: 42,081
Пропиле́н (пропен) — СН2=СН-СН3 — непредельный (ненасыщенный) углеводород ряда этилена, горючий газ. Вещество с наркотическим действием более сильным, чем у этилена. Класс опасности — четвертый.
Физические свойства
Пропилен представляет собой газообразное вещество с низкой температурой кипения tкип= −47,6 °C и температурой плавления tпл= −187,6 °C, оптическая плотность d204=0,5193. плотность по воздуху=1.45(по справочнику Баратова).
Химические свойства
Обладает значительной реакционной способностью. Его химические свойства определяются двойной углерод-углеродной связью. p-связь, как наименее прочная и более доступная, при действии реагента разрывается, а освободившиеся валентности углеродных атомов затрачиваются на присоединение атомов, из которых состоит молекула реагента. Все реакции присоединения протекают по двойной связи и состоят в расщеплении π-связи алкена и образовании на месте разрыва двух новых σ-связей. Чаще реакции присоединения идут по гетеролитическому типу, являясь реакциями электрофильного присоединения.
Присоединение галогенов (галогенирование)
Реакцию галогенирования обычно проводят в растворителе при обычной температуре. Галогены легко присоединяются по месту разрыва двойной связи с образованием дигалогенопроизводных. Легче идет присоединение хлора и брома, труднее — йода. Фтор взаимодействует со взрывом.
Присоединение водорода (реакция гидрирования)
Присоединяя водород в присутствии катализаторов (Pt, Pd, Ni), пропилен переходит в предельный углеводород — пропан.
Присоединение воды (реакция гидратации)
Пропилен реагирует с водой с образованием одноатомного спирта изопропанола, при этом двойная связь раскрывается.
Присоединение галогеноводородов (HHal)
Происходит по правилу Марковникова. Водород кислоты HHal присоединяется к наиболее гидрированному атому углерода при двойной связи. Соответственно остаток Hal связывается с атомом углерода, при котором находится меньшее число атомов водорода. Пример гидрогалогенирования — получение бромпроизводного пропана при реакции бромоводорода и пропилена.
Горение на воздухе
При поджигании горит на воздухе. С кислородом воздуха газообразный пропилен образует взрывчатые смеси.
Окисление
В слабощелочной или нейтральной водной среде пропилен окисляется перманганатом калия, что сопровождается обесцвечиванием раствора KMnO4 и образованием гликолей (соединений с двумя гидроксильными группами при соседних атомах углерода). Эта реакция получила название реакции Вагнера.
Полимеризация
Условия реакции: нагревание, присутствие катализаторов. Соединение молекул происходит путём расщепления внутримолекулярных π-связей и образования новых межмолекулярных σ-связей.
Получение
В промышленности
Обычно пропилен выделяют из газов нефтепереработки (при крекинге сырой нефти в кипящем слое (процесс фирмы BASF), пиролизе бензиновых фракций) или попутных газов, а также из газов коксования угля. Существует несколько видов пиролиза пропилена: пиролиз в трубчатых печах, пиролиз в реакторе с кварцевым теплоносителем (процесс фирмы Phillips Petroleum Co.), пиролиз в реакторе с коксовым теплоносителем (процесс фирмы Farbewerke Hoechst), пиролиз в реакторе с песком в качестве теплоносителя (процесс фирмы Lurgi), пиролиз в трубчатой печи (процесс фирмы Kellogg), процесс Лавровского — Бродского, автотермический пиролиз по Бартоломе. В промышленности пропилен получают также дегидрированием алканов в присутствии катализатора (Сr2О3, Аl2О3). Промышленным способом получения пропилена наряду с крекингом служит дегидратация пропанола над оксидом алюминия. При выпуске с производства, при товарно-учетных операциях, при проверке его на соответствие нормативно-технической документации производится отбор проб пропилена по процедуре, описанной в ГОСТ 24975.0-89 "Этилен и пропилен. Методы отбора проб". Отбор пробы пропилена может производится и в газообразном и в сжиженном виде в специальные пробоотборники по ГОСТ 14921.
Применение
Для производства оксида пропилена, получения изопропилового спирта и ацетона, для синтеза альдегидов, для получения акриловой кислоты и акрилонитрила, полипропилена, пластмасс, каучуков, моющих средств, компонентов моторных топлив, растворителей.
Производство
Большая часть производственных мощностей по пропилену сосредоточена в Европе, Северной Америке и Азии. В настоящее время за год в мире производится более 50 миллионов тонн пропилена полимерного и химического сортов (PG/CG). Большая часть выпуска пропилена этих сортов приходится на долю установок пиролиза, где пропилен — побочный продукт производства этилена. Установками термического крекинга вырабатывается более 60 % такого пропилена. Нефтеперерабатывающими FCC-предприятиями выпускается 34 %. При дегидрогенизации или метатезисе пропана производится 3 % пропилена (в данном случае пропилен является целевым продуктом). Пропилен нефтехимической чистоты (RG) производится на нефтеперерабатывающих предприятиях мира в количестве, равном 31,2 миллионам тонн. Большая часть такого пропилена вырабатывается на FCC-предприятиях, где пропилен — побочный продукт производства бензина и дистиллятов. Половина этих пропиленовых мощностей интегрирована с нефтехимическими предприятиями, на которых происходит алкилирование пропилена или смешивание LPG и пропана.
