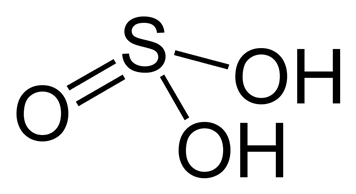
Структурная формула
 |
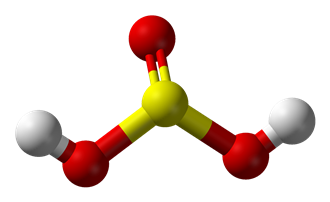 |
Истинная, эмпирическая, или брутто-формула: H2SO3
Химический состав Сернистой кислоты
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| H | Водород | 1,008 | 2 | 2,5% |
| O | Кислород | 15,999 | 3 | 58,5% |
| S | Сера | 32,064 | 1 | 39,1% |
Молекулярная масса: 82,077
Сернистая кислота — неустойчивая двухосновная неорганическая кислота средней силы. Отвечает степени окисления серы +4. Химическая формула H2SO3
Химические свойства
Кислота средней силы. Существует лишь в разбавленных водных растворах (в свободном состоянии не выделена). Растворы H2SO3 всегда имеют резкий специфический запах химически не связанного водой SO2. Двухосновная кислота, образует два ряда солей: кислые — гидросульфиты (в недостатке щёлочи) и средние — сульфиты (в избытке щёлочи). Как и сернистый газ, сернистая кислота и её соли являются сильными восстановителями. При взаимодействии с ещё более сильными восстановителями может играть роль окислителя. Качественная реакция на сульфит-ионы — обесцвечивание раствора перманганата калия.
Применение
Сернистую кислоту и её соли применяют как восстановители, для беления шерсти, шелка и других материалов, которые не выдерживают отбеливания с помощью сильных окислителей (хлора). Сернистую кислоту применяют при консервировании плодов и овощей. Гидросульфит кальция (сульфитный щелок, Са(HSO3)2) используют для переработки древесины в так называемую сульфитную целлюлозу (раствор гидросульфита кальция растворяет лигнин — вещество, связывающее волокна целлюлозы, в результате чего волокна отделяются друг от друга; обработанную таким образом древесину используют для получения бумаги).
