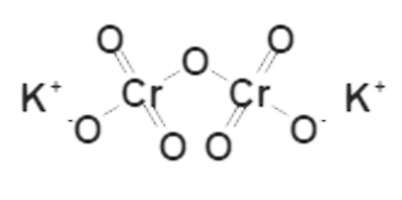
Структурная формула
 |
 |
Истинная, эмпирическая, или брутто-формула: K2Cr2O7
Химический состав Дихромата калия
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| Cr | Хром | 51.996 | 2 | 35,3% |
| K | Калий | 39.102 | 2 | 26,6% |
| O | Кислород | 15.999 | 7 | 38,1% |
Молекулярная масса: 294,189
Дихрома́т ка́лия (двухромовокислый калий, бихромат калия, техн.: хро́мпик) — K2Cr2O7.
Хорошо растворим в воде. В кислой среде проявляет сильные окислительные свойства, восстанавливаясь до солей хрома (III). Например, он окисляет галогенид-ионы галогенводородных кислот до свободных галогенов. Кристаллический дихромат калия также обладает окислительными свойствами. Например, сера и углерод восстанавливают его до оксида хрома (III).
Применяется при производстве красителей, при дублении кож и овчин, как окислитель в спичечной промышленности, пиротехнике, фотографии, живописи. Раствор хромпика в серной кислоте (т. н. хромовую смесь) применяют для мытья стеклянной посуды в лабораториях. В лабораторной практике используется в качестве окислителя, в том числе в аналитической химии (хроматометрия).
Высокотоксичен, канцерогенен, брызги его раствора разрушают кожные покровы, дыхательные пути и хрящевые ткани. ПДК 0,01 мг/м³ (в пересчете на CrO3). При работе с дихроматом калия необходимо применять защиту органов дыхания и кожи.
Получают действием хлорида калия на дихромат натрия.
