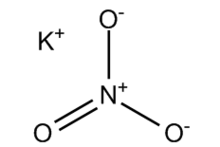
Структурная формула
 |
 |
Истинная, эмпирическая, или брутто-формула: KNO3
Химический состав Нитрата калия
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| K | Калий | 39,102 | 1 | 38,7% |
| N | Азот | 14,007 | 1 | 13,9% |
| O | Кислород | 15,999 | 2 | 47,5% |
Молекулярная масса: 101,106
Нитра́т ка́лия, азотноки́слый ка́лий (ка́лиевая сели́тра, кали́йная селитра, индийская селитра и др.) - неорганическое соединение, калиевая соль азотной кислоты с формулой KNO3. В кристаллическом состоянии — бесцветное вещество, нелетучее, слегка гигроскопичное, без запаха. Нитрат калия хорошо растворим в воде. Практически не токсичен для живых организмов.
Встречается в природе в виде минерала нитрокалита, в Ост-Индии находится одно из крупнейших месторождений, отсюда второе название — индийская селитра. В очень малых количествах содержится в растениях и животных.
Форма кристаллов игольчатая, сами кристаллы очень длинные. Легко поддается очистке перекристаллизацией с минимальными потерями.
Основное применение находит в пиротехнике (до XX века особенно широко, как компонент основного в то время взрывчатого вещества — дымного (чёрного) пороха) и как калий-азотное удобрение (очень удобное соединение двух обычно плохо сочетающихся при усваивании растениями элементов).
Физические свойства
Нитрат калия в нормальных условиях представляет собой бесцветные кристаллы (в измельченном состоянии белый порошок) с ионной структурой и ромбической или гексагональной кристаллической решеткой. Слегка гигроскопичен, склонен несильно слеживаться со временем. Не имеет запаха, нелетуч. Хорошо растворим в воде, в средней степени в глицерине, жидком аммиаке, гидразине, нерастворим в чистом этаноле и эфире (в разбавленных водой растворяется плохо). Таблица растворимости в некоторых растворителях, в граммах KNO3 на 100 г H2O:
| Растворитель / Температура | 0 °С | 10 °С | 20 °С | 25 °С | 30 °С | 40 °С | 50 °С | 60 °С | 70 °С | 80 °С | 90 °С | 100 °С |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Вода | 13,9 | 21,2 | 31,6 | 37,9 | 46,0 | 61,3 | 106,2 | 166,6 | 245,0 | |||
| Жидкий аммиак | 10,52 | 10,4 | ||||||||||
| Гидразин | 14 | |||||||||||
| Диэтиловый эфир | ||||||||||||
| Этанол | ||||||||||||
| Метанол | ||||||||||||
| Глицерин |
При медленной кристаллизации вырастают очень длинные игольчатые кристаллы. Нитрат калия хорошо поддается очистке перекристаллизацией, причём с небольшими потерями, благодаря сильному повышению растворимости с ростом температуры.
Химические свойства
- Разлагается при 400—520 °C с образованием нитрита калия KNO2 и кислорода O2 (выделение последнего увеличивает пожароопасность нитрата калия):
2KNO3 → 2KNO2 + O2 - Является сильным окислителем, реагирует с горючими материалами и восстановителями, при измельчении активно и нередко со взрывом. Смеси нитрата калия с некоторыми органическими материалами склонны к самовоспламенению.
- Восстанавливается водородом в момент выделения (в реакции соляная кислота разбавленная):
Zn + 2HCl → ZnCl2 + 2H0
KNO3 + 2H0 → KNO2 + H2O - Расплав нитрата калия может быть использован для получения калия электролизом, однако из-за высоких окислительных способностей нитрата калия в этом состоянии предпочтительнее гидроксид калия.
Получение
В Средние Века и Новое Время (когда активно использовали порох) для получения нитрата калия служили селитря́ницы — кучи из смеси навоза (и других перегнивающих компонентов) с известняком, строительным мусором и прочим известняковым материалом с прослойками из соломы или хвороста, накрытые дёрном для удерживания образующихся газов. При гниении навоза образовывался аммиак, который накапливаясь в прослойках из соломы, подвергался нитрификации и превращался вначале в азотистую, а затем в азотную кислоту. Последняя, взаимодействуя с известняком, давала Ca (NO3)2, который выщелачивался водой. Добавка древесной золы (состоящей в основном из поташа) приводила к осаждению CaCO3 и получению раствора нитрата калия; нередко золу добавляли сразу в кучу вместо известняка, тогда калиевая селитра получалась сразу. Реакция поташа с кальциевой селитрой (нитратом кальция).
Ca(NO3)2 + K2CO3 → 2KNO3 + CaCO3
является самой древней из используемых человеком для получения нитрата калия и популярна до сих пор. Вместо поташа впрочем, сейчас в лабораториях чаще всего используют сульфат калия, реакция очень похожа:
Ca(NO3)2 + K2SO4 → KNO3 + CaSO4
Первый способ применялся до 1854 г., когда немецкий химик К. Нёльнер изобрел производство нитрата калия, основанное на реакции более доступных и дешевых хлорида калия и нитрата натрия:
KCl + NaNO3 → KNO3 + NaCl
Существует несколько других способов получения нитрата калия. Это взаимодействие нитрата аммония и хлорида калия с образованием нитрата калия и хлорида аммония, последний легко отделяется:
KCl + NH4NO3 → KNO3 + NH4Cl
KOH + HNO3 → KNO3 + H2O
21K + 26HNO3 → 21KNO3 + NO + N2O + N2+13H2 — тоже демонстративная реакция соответствующих кислоты и металла
K2O + 2HNO3 → 2KNO3 + H2O — демонстр. реакция соотв. щелочного оксида с соотв. кислотой
2KOH + N2O5 → 2KNO3 + H2O
NH4NO3 + KOH → NH3 + KNO3 + H2O
K2CO3 + 2HNO3 → 2KNO3 + H2O + CO2
Природные источники и месторождения
В природе нитрат калия распространен в виде минерала нитрокалита. Крупнейшее его месторождение находится в Ост-Индии. Природный нитрат калия является результатом разложения азотистых веществ с последующим связыванием медленно выделяющегося аммиака нитробактериями, чему способствует влага и тепло, поэтому наиболее крупные залежи находятся в странах с жарким климатом.
В очень малых количествах содержится в растениях и животных, является промежуточным продуктом при переработке ими почвенных сульфата и карбоната калия.
Применение
Основное применение на сегодняшний день нитрат калия находит в качестве ценного удобрения, так как совмещает в себе два элемента, частично блокирующих усвоение друг друга растениями, когда находятся в составе отдельных соединений.
Незаменим он при изготовлении дымного пороха и некоторых других составов (например, карамельного ракетного топлива), которые почти полностью сейчас идут на производство пиротехники.
Применяется также в электровакуумной промышленности и оптическом стекловарении для обесцвечивания и осветления технических хрустальных стекол и придания прочности изделиям из стекла.
Расплав часто используется в лабораториях и у любителей для получения элементарного калия электролизом, наряду с гидроксидом калия.
Используется в качестве сильного окислителя в металлургии, в частности при переработке никелевых руд.
В пищевой промышленности нитрат калия применяется в качестве консерванта E252. Сам по себе он не имеет хорошо выраженного антибактериального воздействия, но его оказывает образующийся в мясных продуктах (где нитрат калия и находит наиболее широкое применение) нитрит калия.
