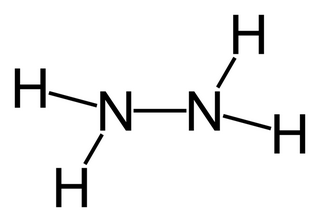
Структурная формула
 |
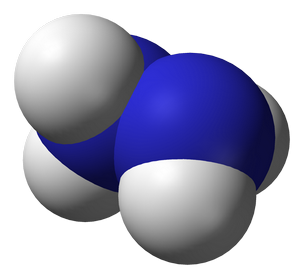 |
Истинная, эмпирическая, или брутто-формула: H4N2
Химический состав Гидразина
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| H | Водород | 1.008 | 4 | 12,6% |
| N | Азот | 14.007 | 2 | 87,4% |
Молекулярная масса: 32.046
Гидразин — (диамид) H2N—NH2 — бесцветная, сильно гигроскопическая жидкость с неприятным запахом. Молекула H4N2 состоит из двух групп NH2, повёрнутых друг относительно друга, что обусловливает полярность молекулы гидразина, μ = 0,62·10−29 Кл · м. Смешивается в любых соотношениях с водой, жидким аммиаком, этанолом; в неполярных растворителях растворяется плохо. Образует органические производные: алкилгидразины и арилгидразины. Был открыт в 1887 году Теодором Курциусом.
Свойства
Термодинамически гидразин значительно менее устойчив, чем аммиак, так как связь N—N не очень прочна: разложение гидразина — экзотермическая реакция, протекающая в отсутствие катализаторов при 200—300 °С. Переходные металлы (Co, Ni, Cu, Ag) катализируют разложение гидразина, при катализе платиной, родием и палладием основными продуктами разложения являются азот и водород. Благодаря наличию двух неподелённых пар электронов у атомов азота, гидразин способен к присоединению одного или двух ионов водорода. При присоединении одного протона получаются соединения гидразиния с зарядом 1+, двух протонов — гидразония с зарядом 2+, содержащие соответственно ионы N2H5+ и N2H62+. Водные растворы гидразина обладают основными свойствами, но его основность значительно меньше, чем у аммиака. Известны соли гидразина — хлорид гидразиния N2H5Cl, сульфат гидразония N2H6SO4 и т. д. Иногда их формулы записывают N2H4 · HCl, N2H4 · H2SO4 и т. д. и называют гидрохлорид гидразина, сульфат гидразина и т. д. Большинство таких солей растворимо в воде. Соли гидразина бесцветны, почти все хорошо растворимы в воде. К числу важнейших относится сульфат гидразина N2H5 · H2SO4.
Гидразин как восстановитель
Гидразин — энергичный восстановитель. В растворах гидразин обычно также окисляется до азота. Восстановить гидразин до аммиака можно только сильными восстановителями, такими, как Sn2+, Ti3+, водородом в момент выделения (Zn + HCl). Окисляется кислородом воздуха до азота, аммиака и воды. Известны многие органические производные гидразина. Гидразин, а также гидразин-гидрат, гидразин-сульфат, гидразин-хлорид, широко применяются в качестве восстановителей золота, серебра, платиновых металлов из разбавленных растворов их солей. Медь в аналогичных условиях восстанавливается до закиси. В органическом синтезе гидразин применяется для восстановления карбонильной группы альдегидов и кетонов до метиленовой по Кижнеру—Вольфу (реакция Кижнера—Вольфа), реакция идёт через образование гидразонов, расщепляющихся затем под действием сильных оснований.
Обнаружение
Качественной реакцией на гидразин служит образование окрашенных гидразонов с некоторыми альдегидами, в частности — с p-диметиламинобензальдегидом.
Получение
Гидразин получают окислением аммиака NH3 или мочевины CO(NH2)2 гипохлоритом натрия NaClO (метод Рашига). Реакция проводится при температуре 160 °C и давлении 2,5−3,0 МПа. Синтез гидразина окислением мочевины гипохлоритом по механизму аналогичен синтезу аминов из амидов по Гофману. Реакция проводится при температуре ~100 °C и атмосферном давлении.
Применение
Гидразин применяют в органическом синтезе, в производстве пластмасс, резины, инсектицидов, взрывчатых веществ, в качестве компонента ракетного топлива. Гидразина сульфат применяется в случае таких заболеваний, как неоперабельные прогрессирующие распространенные формы, рецидивы и метастазы злокачественных опухолей — рак легкого (особенно немелкоклеточный), молочных желез, желудка, поджелудочной железы, гортани, эндометрия, шейки матки, десмоидный рак, саркома мягких тканей, фибросаркома, нейробластома, лимфогранулематоз, лимфосаркома (монотерапия или в составе полихимиотерапии). Гидразин и его производные (метилгидразин, несимметричный диметилгидразин и их смеси (аэрозин)) широко распространены как ракетное горючее. Они могут быть использованы в паре с самыми разными окислителями, а некоторые и в качестве однокомпонентного топлива, в этом случае рабочим телом двигателя являются продукты разложения на катализаторе. Последнее удобно для маломощных двигателей. Во время Второй мировой войны гидразин применялся в Германии в качестве одного из компонентов топлива для реактивных истребителей «Мессершмитт Ме-163» (C-Stoff, содержащий до 30 % гидрата гидразина) и ракет «Фау-2» (B-Stoff, 75 % гидразина).
| Окислитель | Удельная тяга (Р1, с*) | Температура сгорания °С | Плотность топлива г/см³ | Прирост скорости, ΔVид,25, м/с | Весовое содерж.горючего % |
|---|---|---|---|---|---|
| Фтор | 364,4 с | °С | 1,314 | 5197 м/с | 31 % |
| Тетрафторгидразин | 334,7 с | °С | 1,105 | 4346 м/с | 23,5 % |
| Кислород | 312,9 с | °С | 1,065 | 3980 м/с | 52 % |
| Азотная кислота | 279,1 с | °С | 1,254 | 5197 м/с | 40 % |
- Удельная тяга равна отношению тяги к весовому расходу топлива; в этом случае она измеряется в секундах (с = Н·с/Н = кгс·с/кгс). Для перевода весовой удельной тяги в массовую её надо умножить на ускорение свободного падения (примерно равное 9,81 м/с²)
Гидразин также применяется в качестве топлива в гидразин-воздушных низкотемпературных топливных элементах. Жидкая смесь гидразина и нитрата аммония используется как мощное взрывчатое средство с нулевым кислородным балансом — астролита, который, однако, в настоящее время практического значения не имеет. Гидразин широко применяется в химической промышленности в качестве восстановителя кислорода, содержащегося в деминерализованной воде, применяемой для питания котлов (котельные установки, производства аммиака, слабой азотной кислоты и др.). При этом протекает следующая химическая реакция: N2H4 + O2 = N2 + 2H2O.
Токсичность
Гидразин и большинство его производных очень токсичны. Небольшие концентрации гидразина вызывают раздражение глаз, дыхательных путей. При повышении концентрации начинается головокружение, головная боль и тошнота. Далее следуют судороги, токсический отёк лёгких, а за ними — кома и смерть. ПДК в воздухе рабочей зоны = 0,1 мг/м2. Относится к первому классу опасности.
