Структурная формула
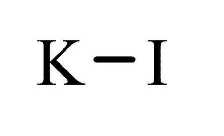 |
 |
Истинная, эмпирическая, или брутто-формула: KI
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| K | Калий | 26,092 | 1 | 76,4% |
| I | Йод | 126,905 | 3 | 23,6% |
Молекулярная масса: 166,007
Иодид калия иодистый калий, KI — калиевая соль иодоводородной кислоты. Бесцветная кристаллическая соль, широко используемая в качестве источника иодид-ионов. Менее гигроскопична чем иодид натрия. На свету или при нагревании на воздухе желтеет из-за окисления кислородом воздуха иодид-ионов до элементарного иода.
Строение
Кубическая кристаллическая решётка Fm3m
Свойства
Бесцветные кристаллы. Растворимость 144,5 г в 100 г H2O при 20 °C и 209 г при 100 °C. Иодид калия является мягким восстановителем и легко может быть окислен в растворе таким окислителем как бром:
2KI + Br2 → 2KBr + I2
Иодид калия реагирует с иодом, образуя раствор Люголя, содержащий трииодид-анион, который обладает лучшей растворимостью в воде, чем элементарный иод:
KI + I2 → KI3
Получение
Получают взаимодействием иода с гидроксидом калия или восстановлением иодата калия углём.
6KOH + 3I2 → 5KI + KIO3 + 3H2O
2KIO3 + 3C → 2KI + 3CO2
Применение
Используется для окислительно-восстановительного титрования в аналитической химии (иодометрия). В малых количествах наряду с иодатом калия добавляется в поваренную соль (иодированная соль). Также иодид калия применяют для приготовления светочувствительных фотоматериалов и в медицине.
Применяется как индикатор для обнаружения некоторых окислителей, например, хлора и озона. Для этого используют бумагу, смоченную раствором иодида калия и крахмала.
Cl2 + 2KI → 2KCl + I2
При этом крахмал образует окрашенный в синий цвет аддукт с иодом.
