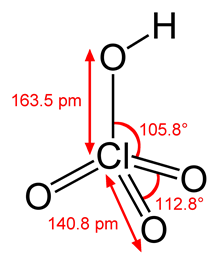
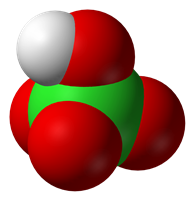
Структурная формула
 |
 |
Истинная, эмпирическая, или брутто-формула: C4H4O
Химический состав Хлорной кислоты
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| H | Водород | 1,008 | 1 | 1% |
| Cl | Хлор | 35,453 | 1 | 35,3% |
| O | Кислород | 15,999 | 4 | 63,7% |
Молекулярная масса: 100,457
Хлорная кислота HClO4 — одноосновная кислота, одна из самых сильных (в водном растворе, pK = ~ -10), безводная — исключительно сильный окислитель, так как содержит хлор в высшей степени окисления +7.
Свойства
Физические свойства
Бесцветная летучая жидкость, сильно дымящая на воздухе, в парах мономерна. Безводная хлорная кислота очень реакционноспособна и неустойчива. Жидкая HClO4 частично димеризована, для неё характерна равновесная автодегидратация: 3HClO4 ↔ H3O+ + ClO4- + Cl2O7
Химические свойства
Взрывоопасна. Хлорную кислоту и её соли (перхлораты) применяют как окислители. Хлорная кислота, как одна из самых сильных кислот, растворяет золото и платиновые металлы, а в реакции с серебром образует хлорноватую кислоту:
3HClO4 + 2Ag = 2AgClO4 + HClO3 + H2O
Неметаллы и активные металлы восстанавливают хлорную кислоту до хлороводорода
8As + 5HClO4 + 12H2O = 8H3AsO4 + 5HCl (данная реакция используется в металлургии для очистки руд)
Перхлорат йода в лаборатории получают при обработке раствора йода в безводной хлорной кислоте озоном:
I2 + 6HClO4 + O3 = 2I(ClO4)3 + 3H2O
Являясь крайне сильной неустойчивой кислотой, хлорная кислота разлагается:
4HClO4 = 4ClO2 + 3O2 + 2H2O
Хлорная кислота хорошо растворима во фтор- и хлорорганических растворителях, таких, как CF3COOH, CHCl3, CH2Cl2 и др. Смешивание с растворителями, проявляющими восстановительные свойства, может привести к воспламенению и взрыву. С водой хлорная кислота смешивается в любых соотношениях и образует ряд гидратов HClO4×nH2O (где n = 0,25…4). Моногидрат HClO4•H2O имеет температуру плавления +50оС. Концентрированные растворы хлорной кислоты, в отличие от безводной кислоты, обладают маслянистой консистенцией. Водные растворы хлорной кислоты устойчивы, имеют низкую окислительную способность. Хлорная кислота с водой образует азеотропную смесь, кипящую при 203 °C и содержащую 72 % хлорной кислоты. Растворы хлорной кислоты в хлорсодержащих углеводородах являются сверхкислотами (суперкислотами). Хлорная кислота является одной из сильнейших неорганических кислот, в её среде даже кислотные соединения ведут себя как основания, присоединяя протон и образуя катионы ацилперхлоратов: P(OH)4+ClO4-, NO2+ClO4-.
При слабом нагревании при пониженном давлении смеси хлорной кислоты с фосфорным ангидридом, отгоняется бесцветная маслянистая жидкость — хлорный ангидрид:
2HClO4 + P4O10 → Cl2O7 + H2P4O11
Соли хлорной кислоты называются перхлоратами.
Получение
- Водные растворы хлорной кислоты получают электрохимическим окислением соляной кислоты или хлора, растворённых в концентрированной хлорной кислоте, а также обменным разложением перхлоратов натрия или калия сильными неорганическими кислотами.
- Безводная хлорная кислота образуется при взаимодействии перхлоратов натрия или калия с концентрированной серной кислотой, а также водных растворов хлорной кислоты с олеумом: KClO4 + H2SO4 → KHSO4 + HClO4
Применение
- Концентрированные водные растворы хлорной кислоты широко используются в аналитической химии, а также для получения перхлоратов.
- Хлорная кислота применяется при разложении сложных руд, при анализе минералов, а также в качестве катализатора.
- Соли хлорной кислоты: перхлорат калия малорастворим в воде, применяется в производстве взрывчатых веществ, перхлорат магния (ангидрон) — осушитель.
