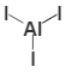
Структурная формула
 |
 |
Истинная, эмпирическая, или брутто-формула: AlI3
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| Al | Алюминий | 26,092 | 1 | 6,4% |
| I | Йод | 126,905 | 3 | 93,6% |
Молекулярная масса: 406,807
Иодид алюминия— неорганическое вещество с химической формулой AlI3. Относится к классу бинарных соединений, также может рассматриваться как соль алюминия и иодоводородной кислоты. Твердое вещество белого цвета с желтоватым оттенком.
Физические свойства
Безводный иодид алюминия при нормальных условиях — белое кристаллическое вещество с гексагональной сингонией кристаллической решётки. Плавится и кипит без разложения, гигроскопичен. Образует кристаллогидрат состава AlI3 • 6H2O светло-жёлтого цвета. Кристаллогидрат хорошо растворим в воде, растворим в этаноле, эфире, сероуглероде.
Химические свойства
Иодид алюминия обладает следующими химическими свойствами.
- Реагирует с концентрированной серной кислотой:
8AlI3 + 15H2SO4 → 4Al2(SO4)3 + 12I2↓ + 3H2S↑ + 12H2O - При поглощении влаги воздуха частично разлагается с образованием осно́вной соли, та же соль образуется при нагревании кристаллогидрата:
AlI3 + 2H2O → Al(OH)2I + 2HI↑
AlI3 • 6H2O →>185°C→ Al(OH)2I + 2HI + 4H2O - При нагревании раствора иодида алюминия выпадает осадок гидроксида алюминия:
AlI3 + 3H2O Al(OH)3↓ + 3HI - В газовой фазе при температуре выше 250 °C происходит частичная димеризация:
2AlI3 ↔ Al2I6 - Кроме того, иодид алюминия обладает всеми свойствами, общими для растворимых солей алюминия.
Получение
Иодид алюминия может быть получен непосредственно реакцией порошкообразного алюминия и иода (для реакции необходимо небольшое количество воды в качестве катализатора — образующиеся при реакции иода с водой кислоты растворяют покрывающую алюминий оксидную плёнку, ускоряя реакцию:
2Al + 3I2 → 2AlI3
Токсичность
Иодид алюминия способен вызывать ожоги кожи и слизистых оболочек (глаз, органов дыхания, ЖКТ). Может вызывать аллергические реакции.
