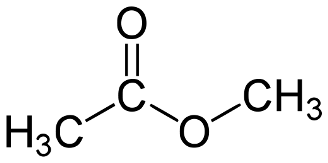
Структурная формула
 |
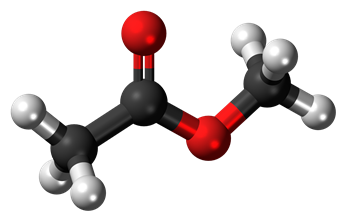 |
Истинная, эмпирическая, или брутто-формула: C3H6O2
Химический состав Метилацетата
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| C | Углерод | 12,011 | 3 | 48,6% |
| H | Водород | 1,008 | 6 | 8,2% |
| O | Кислород | 15,999 | 2 | 43,2% |
Молекулярная масса: 74,079
Метилацетат (метиловый эфир уксусной кислоты, метиловый эфир этановой кислоты, уксуснометиловый эфир, MeOAc) CH3COOCH3 — органическое вещество класса сложных эфиров.
Встречается в природе, большей частью в эфирных маслах растений (например, до 8,9 % в различных видах мяты, до 28,2 % в лабазнике, до 44 % в жасмине), и в пищевых продуктах (например, в коньяках многолетней выдержки).
Физические свойства
Бесцветная прозрачная жидкость с фруктовым запахом.
Хорошо смешивается с органическими растворителями. По растворяющей способности аналогичен ацетону и применяется в ряде случаев как его заменитель. Смешивается в любых соотношениях с этанолом и этиловым эфиром, хорошо растворим в ацетоне и хлороформе, растворим в бензоле.
Некоторые свойства отличаются по разным источникам: плотность 0,9330 и 0,9244г/см3; показатель преломления 1,3619 и 1,3593; динамическая вязкость 0,362 и 0,381. Растворимость в воде 31,9 %, образует с водой азеотропную смесь (температура кипения 56,4 °C, 96,7 % метилацетата). Образует азеотропные смеси с метанолом (температура кипения 54 °C, 81 % метилацетата) и ацетоном (температура кипения 56,1 °C, 45 % метилацетата).
Образует аддукты: метилацетат•SbCl5, метилацетат•HSbCl6 и метилацетат•BF3, плавящиеся, соответственно, при 87-88, 81-82 и 65,5 °С.
Взрывоопасные концентрации в смеси с воздухом 3,15 — 15,60 %.
Химические свойства
По химическим свойствам метилацетат представляет собой типичный сложный эфир алифатической монокарбоновой кислоты.
Легко гидролизуется (омыляется) на исходные спирт и кислоту водой (обратимо) или щелочами (необратимо, так как образующаяся карбоновая кислота превращается в соль):
CH3COOCH3 + H2O → CH3COOH + CH3OH
Восстановление метилацетата приводит к образованию двух спиртов:
CH3COOCH3 + 2H2 → CH3CH2OH + CH3OH
Под действием аммиака метилацетат превращается в ацетамид и спирт:
CH3COOCH3 + NH3 → CH3CONH2 + CH3OH
Получение
Метилацетат получают этерификацией уксусной кислоты метанолом в жидкой фазе в присутствии серной кислоты (или при пропускании смеси паров указанных жидкостей над нагретыми катализаторами: FeCl3, AlCl3):
CH3COOH + CH3OH → CH3COOCH3 + H2O
а также из уксусного ангидрида и метанола (реакция протекает в жидкой фазе в отсутствии катализатора и является практически необратимой):
(CH3CO)2O + CH3OH → CH3COOCH3 + CH3COOH
Кроме синтетических методов, также производится пиролизом древесины.
Применение
Метилацетат применяют, в основном, в качестве растворителя в производстве лакокрасочных материалов и как компонент многих промышленных и бытовых растворителей. Является составной частью (7-75 %) лесохимических растворителей. Используется при производстве клеев, композиционных лаков, шпатлевок, магнитных лент, автокосметики, эфиров целлюлозы, поливинилацетата, полиметилметакрилата, растительных и животных жиров, многих синтетических смол. Применяется как экстрагент в аналитической химии, в том числе для отделения LiCl от хлоридов других щелочных металлов.
Метилацетат является ценным компонентом для промышленного синтеза, в том числе — из него карбонилированием получают уксусный ангидрид (процесс Реппеruen):
CH3CO2CH3 + CO → (CH3CO)2O
Используется в пищевой промышленности в качестве ароматизатора и экстрактивного растворителя в процессе декофеинизирования чая и кофе. В качестве ароматизатора и растворителя также входит в состав ряда косметических средств.
Токсичность
Слабо раздражает слизистые оболочки глаз и дыхательных путей (при концентрации 15 мг/л химически чистого метилацетата для ощущения раздражения требуется 5-минутная экспозиция). В высоких концентрациях оказывает лёгкое наркотическое воздействие, — в основном, за счёт действия самого сложного эфира, и, в меньшей степени, — за счёт образующегося из него спирта.
При пероральном введении ЛД50 = 2,9 г/кг (белые крысы), 2,4 г/кг (мыши и кролики), 3,6 г/кг (морские свинки).
ПДК в воздухе рабочих зон 100 мг/м³. ПДК в атмосферном воздухе населенных мест 0,07 мг/м³.
