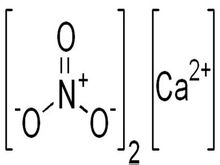
Структурная формула
 |
 |
Истинная, эмпирическая, или брутто-формула: CaN2O6
Химический состав Нитрата кальция
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| Ca | Кальций | 40,08 | 1 | 24,4% |
| N | Азот | 14,007 | 2 | 17,1% |
| O | Кислород | 15,999 | 6 | 58,5% |
Молекулярная масса: 164,088
Кальция нитрат(кальциевая селитра, азотнокислый кальций) — неорганическая соль азотной кислоты. Соединение сильно гигроскопично, поэтому его хранят без доступа влаги. Химическая формула Са(NО3)2.
Свойства
Химические свойства
При 500 °C начинает разлагаться с выделением О2 и образованием сначала Ca(NO2)2, а затем СаО и NO2. Кальциевая селитра при нормальных условиях негорючая, пожаро- и взрывобезопасная, устойчивая в интервале температур от −60 °C до +155 °C.
Получение
Получают кальция нитрат действием HNO3 на известняк или поглощением нитрозных газов (в основном NO2) известковым молоком. Применяют кальция нитрат как азотное удобрение и для получения особо чистого СаО. Для получения гранулированной кальциевой селитры используется способ низкотемпературной нейтрализации азотной кислоты природным известняком или продуктами переработки известняка.
Реакции с получением нитрата кальция
Нитрат кальция производится путём обработки известняка с азотной кислотой, после нейтрализации аммиака:
CaCO3 + 2HNO3 → Ca(NO3)2 + CO2 + H2O.
Он также является побочным продуктом процесса Оддо при добыче фосфата кальция:
Ca3(PO4)2 + 6HNO33PO4 + 3Ca(NO3)2.
Так же как нитраты других щелочноземельных металлов и LiNO3, кальциевая селитра при нагревании разлагается на выпуске диоксида азота:
2Ca(NO3)2 → 2CaO + 4NO2 + O2, ΔH°обр.=369 кДж/моль
Также нитрат кальция можно получить проделав следующие реакции:
- 4Ca + 10HNO3 → 4Ca(NO3)2 + N2O + 5H2O
- CaO + 2HNO3 → Ca(NO3)2 + H2O
- Ca(OH)2 + 2HNO3 → Ca(NO3)2 + 2H2O
- CaCl2 + 2AgNO3 → Ca(NO3)2 + 2AgCl
- 3Ca+8HNO3 → 3Ca(NO3)2 + 2NO + 4H2O
- 2Ca(OH)2 + 4NO2 → Ca(NO3)2+Ca(NO2)2 + 2H2O
- 3Ca(NO2)2 + 4HNO3 → 3Ca(NO3)2 + 2H2O + 4NO
- Ca5(PO4)3F + 10HNO3 → 3H3PO4 + 5Ca(NO3)2 + HF
- CaF2 + 2HNO3 → Ca(NO3)2 + 2HF
- 2Ca5(PO4)3 + F + 14HNO3 → 3Ca(H2PO4)2 + 7Ca(NO3)2 + 2HF
- Ca5(PO4)3 + F + 4HNO3 → 3CaHPO4 + 2Ca(NO3)2 + HF
- 2NH4NO3 + Ca(OH)2 → Ca(NO3)2 + 2H2O + 2NH3
- Ca(PH2O2)2 + 2H2O + 4AgNO3 → 4Ag + 2H2(PHO3) + Ca(NO3)2 + 2HNO3
- CaS + 4HNO3(конц.) → Ca(NO3)2 + S + 2NO2 + 2H2O
- CaHPO4 + 2HNO3(конц.) → Ca(NO3)2 + H3PO4
- Ca(NO3)2 * 4H2O → (60-100oC) Ca(NO3)2 + 4H2O
Применение
Гранулированный, безводный нитрат кальция, применяется как добавка в бетон, в качестве удобрения, для приготовления рассола в холодильной технике, в производстве реактивов, стеклопластиков, а также как один из компонентов для производства взрывчатки.
В сельском хозяйстве
Нитрат кальция является физиологическим щелочным удобрением, пригодным для всех почв и прежде всего для закисленных почв. В сельском хозяйстве применяют как азотное удобрение. Выпускают в гранулированном виде; товарный продукт должен содержать не менее 15,5 % азота, кроме того, к нему добавляют в процессе производства 4—7 % нитрата аммония для уменьшения гигроскопичности удобрения; содержание влаги не должно превышать 15 %. Нитрат кальция вносят под все культуры. Наиболее эффективен на кислых почвах, особенно для весенней подкормки озимых.
В пиротехнике
Несмотря на то, что нитрат кальция в смеси с горючими веществами способен давать недорогой источник кирпично-красного пламени, применение его в этом качестве крайне ограничено из-за сильной гигроскопичности.
