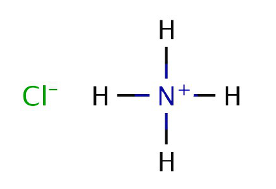
Структурная формула
 |
 |
Истинная, эмпирическая, или брутто-формула: H4ClN
Химический состав Хлорида аммония
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| Cl | Хлор | 35,453 | 1 | 66,3% |
| H | Водород | 1,008 | 4 | 7,5% |
| N | Азот | 14,007 | 1 | 26,2% |
Молекулярная масса: 53,492
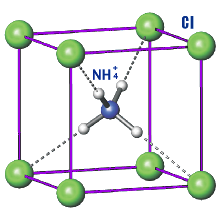
Хлорид аммония (хлористый аммоний, техническое название — нашаты́рь) NH4Cl — соль аммония, белый кристаллический слегка гигроскопичный порошок без запаха.
Физические свойства
Растворимость безводного NH4Cl (в г/100 г воды) при температуре
| 0 °C | 10 °C | 20 °C | 30 °C | 40 °C | 50 °C | 60 °C | 70 °C | 80 °C | 90 °C | 100 °C |
|---|---|---|---|---|---|---|---|---|---|---|
| 29,4 | 33,3 | 37,2 | 41,4 | 45,8 | 50,4 | 55,2 | 60,2 | 65,6 | 71,3 | 77,3 |
Химические свойства
- реагирует с щелочами:
NH4Cl + NaOH → NaCl + H2O + NH3 - реагирует с нитритом натрия при нагревании, с образованием хлорида натрия, азота и воды:
NH4Cl + NaNO2 → NaCl + N2 + 2H2O - под действием электрического тока разлагается с образованием хлористого азота NCl3
Получение
В промышленности хлорид аммония получают упариванием маточного раствора, остающегося после отделения гидрокарбоната натрия NaHCO3 после реакции, в которой углекислый газ пропускают через раствор аммиака и хлорида натрия.
NH3 + H2O+CO2 + NaCl → NaHCO3 + NH4Cl
В лаборатории хлорид аммония получают взаимодействием хлороводорода с аммиаком при пропускании их через раствор NaCl.
Иногда используют реакцию взаимодействия аммиака с хлором:
8NH3 + 3Cl2 → N2 + 6NH4Cl
