Структурная формула
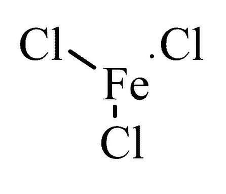 |
 |
Истинная, эмпирическая, или брутто-формула: Cl3Fe
Химический состав Хлорида железа (lll)
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| Cl | Хлор | 35,453 | 3 | 65,6% |
| Fe | Железо | 55,849 | 1 | 34,4% |
Молекулярная масса: 162,208
Хлорид железа (lll)хлорное железо FeCl3 — средняя соль трёхвалентного железа и соляной кислоты.
Физические свойства
Мерцающие, черно-коричневые, либо темно-красные, либо фиолетовые в проходящем свете, зеленые в отраженном свете листочки с металлическим блеском. Сильно гигроскопичен, на воздухе превращается в гидрат FeCl3· 6Н2О — гигроскопичные жёлтые, по другим источникам желто-коричневые кристаллы, хорошо растворимые в воде (при 20 °C в 100 г воды растворяется 91,9 г безводной соли). Tпл 309 °C.
Методы получения
- Самым простым методом получения трихлорида железа является действие на железные опилки или раскалённую железную проволоку газообразным хлором. При этом, в отличие от действия соляной кислоты, образуется соль трёхвалентного железа — выделяется бурый дым из мельчайших её частиц:
2Fe + 3Cl2 → 2FeCl3 - Также трихлорид получается при окислении хлором хлорида железа(II):
2FeCl2 + Cl2 → 2FeCl3 - Также существует достаточно интересный метод окисления оксидом серы(IV):
4FeCl2 + SO2 + 4HCl → 4FeCl3 + S + 2Н2О
Химические свойства
- При нагревании в атмосферном давлении до температуры плавления начинается медленное разложение трихлорида железа с образованием дихлорида и молекулярного хлора:
2FeCl3 → 2FeCl2 + Cl2 - За счёт того, что трихлорид железа является сильной кислотой Льюиса, он вступает во взаимодействие с некоторыми другими хлоридами, при этом образуются комплексные соли тетрахлороферратной кислоты:
FeCl3 + Cl- → [FeCl4]- - При нагревании до 350 °C с оксидом железа(III) образуется оксохлорид железа:
FeCl3 + Fe2O3 → 3FeOCl - Соли трёхвалентного железа являются слабыми окислителями, в частности, трихлорид железа хорошо окисляет металлическую медь, переводя её в растворимые хлориды:
FeCl3 + Cu → FeCl2 + CuCl
FeCl3 + CuCl → FeCl2 + CuCl2 - реагирует с иодоводородом:
2FeCl3 + 2HI → 2FeCl2 + I2 + 2HCl
Применение
- Хлорид железа(III) применяется при травлении печатных плат (радиотехника, системотехника).
- Используется для травления печатных форм (офорт, цинкография), как альтернатива азотной кислоты, реакция с которой сопровождается выделением высокотоксичных паров («лисий хвост»).
- Применяется как протрава при крашении тканей.
- В промышленных масштабах применяется как коагулянт для очистки воды.
- За счёт чётко выраженных кислотных свойств, широко применяется в качестве катализатора в органическом синтезе. Например, для реакции электрофильного замещения в ароматических углеводородах.
Безопасность
Хлорид железа(III) является токсичным, высококоррозионным соединением. Безводная соль служит осушителем.
