Структурная формула
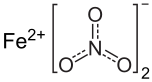 |
 |
Истинная, эмпирическая, или брутто-формула: FeN2O6
Химический состав Нитрата железа II
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| Fe | Железо | 55,849 | 1 | 31,1% |
| N | Азот | 14,007 | 2 | 15,6% |
| O | Кислород | 15,999 | 6 | 53,4% |
Молекулярная масса: 179,857
Нитрат железа(II) - неорганическое химическое соединение, соль азотной кислоты и двухвалентного железа.
Физические свойства
Нитрат железа (II) существует в основном в виде кристаллогидратов Fe(NO3)2·6H2O и Fe(NO3)2·9H2O.
Гексагидрат нитрата железа (II) Fe(NO3)2·6H2O - светло-зелёные кристаллы с ромбической кристаллической решеткой. Хорошо растворяется в воде, причем растворимость растёт вместе с повышением температуры. В равновесии с насыщенным водным раствором существует в интервале от -12 до 60,5 °C и концентрации раствора в пределах 39-69,5%. При более низких температурах и концентрациях растворов устойчив нонагидрат нитрата железа (II) Fe(NO3)2·9H2O.
Особые точки:
Состояние
Температура, °С
Концентрация, %
Лед+Fe(NO3)2·9H2O
-28
(35)
Fe(NO3)2·9H2O + Fe(NO3)2·6H2O
~-12
(39)
Fe(NO3)2·6H2O
60,5
62,5
Получение
Нитрат железа (II) образуется при растворении железа в разбавленной азотной кислоте на холоде:
4Fe + 10HNO3 → 4Fe(NO3)2 + NH4NO3 + 3H2O
В чистом состоянии его лучше получать обменной реакцией сульфата железа (II) с нитратом свинца (II):
FeSO4 + Pb(NO3)2 → PbSO4 + Fe(NO3)2
Химические свойства
Проявляет восстановительные свойства. Гидролиз практически не проявляется.
- Водный раствор нитрата железа (II) разлагается при кипячении с образованием основного нитрата железа (III):
4Fe(NO3)2 + O2 + 2H2O t→ 4Fe(OH)(NO3)2 - Реагирует с щелочами с образованием гидроксида железа (II):
Fe(NO3)2 + 2NaOH → Fe(OH)2 + 2NaNO3 - С растворимыми карбонатами дает белый карбонат железа(II):
Fe(NO3)2 + K2CO3 → FeCO3 + 2KNO3 - Восстанавливается до металлического железа при действии более активного металла:
Fe(NO3)2 + Mg → Fe + Mg(NO3)2 - Взаимодействует с гексацианоферратом (III) калия (красной кровяной солью) с образованием тёмно-синего осадка гексацианоферрата (II) железа(III)-калия (берлинская лазурь):
Fe(NO3)2 + K3[Fe(CN)6] → KFe[Fe(CN)6] + 2KNO3
