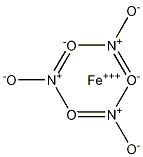
Структурная формула
 |
 |
Истинная, эмпирическая, или брутто-формула: FeN3O9
Химический состав Нитрата железа III
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| Fe | Железо | 55,849 | 1 | 23,1% |
| N | Азот | 14,007 | 3 | 17,4% |
| O | Кислород | 15,999 | 9 | 59,5% |
Молекулярная масса: 241,861
Нитрат железа(III) - неорганическое химическое соединение, соль азотной кислоты и трехвалентного железа.
Физические свойства
При обычной температуре в зависимости от концентрации и содержания в растворе кислоты нитрат железа (III) кристаллизуется в виде почти бесцветных кубиков, имеющих состав Fe(NO3)3·6H2O, или в моноклинных кристаллах состава Fe(NO3)3·9H2O.
Гексагидрат нитрата железа(III) Fe(NO3)3·6H2O — бесцветные гигроскопичные кристаллы с кубической решёткой. Образуется при кристаллизации из водных растворов с содержанием HNO3 не менее 57 % и 28 % Fe(NO3)3.
Нонагидрат нитрата железа (III) со следами гидролиза
Нонагидрат нитрата железа(III) Fe(NO3)3·9H2O — очень гигроскопичные светло-фиолетовые кристаллы с моноклинной решёткой (a = 0,140 нм, b = 0,970 нм, c = 1,103 нм, β=95,52°, пространственная группа P21/с). Хорошо растворяются в воде. При нагревании плавится при 50,1 °C. Процесс сопровождается частичным разложением исходного продукта с выделением HNO3 и последующим кипячением раствора при 125 °C.
Таблица растворимости нитрата железа (III) в воде (в пересчете на безводную соль):
Температура, °С
Концентрация,
г/100 г водыКонцентрация, %
0
67,08
40,15
20
82,48
45,2
40
104,83
51,18
Безводный нитрат железа(III) получить не удалось.
В растворе бледно-фиолетовый гексаакваанион [Fe(H2O)6]3+ преобладает только в том случае, если pH~0. При более высоких значениях pH раствор желтеет из-за гидролиза, а если pH выше 2-3, происходит дальнейшая конденсация и начинается образование коллоидных гелей, и в конечном итоге образуется красновато-коричневый осадок гидратированного оксида железа (III).
Получение
- Нитрат железа(III) получают взаимодействием железной стружки с 20-30 % раствором азотной кислоты:
Fe + 4HNO3 → Fe(NO3)3 + 2H2O + NO - В производстве этот процесс проводят, продувая через раствор воздух:
4Fe+12HNO3 + 3O2 → 4Fe(NO3)3 + 6H2O - В лабораторной практике нитрат железа(III) можно получить обменной реакцией:
Fe2}(SO4)3 + 3Ba(NO3)2 → 2Fe(NO3)3 + 3BaSO4 - Добавив к гидроксонитрату церия(IV) азотную кислоту и сульфат железа(II), получим следующие продукты реакции:
Ce(NO3)3OH + 3HNO3 + FeSO4 → Ce(NO3)3 + Fe(NO3)3+H2SO4 + H2O Ce(NO3)3 + Fe(NO3)3 + H2SO4 + H2O
Химические свойства
- В водных растворах нитрат железа(III) подвергается сильному гидролизу:
Fe(NO3)3 + 2H2O2NO3 + 2HNO3
Равновесие можно сместить в обратную сторону сильно подкислив раствор HNO3. - Разрушается разбавленными щелочами:
2Fe(NO3)3 + 6NaOH+(n-6)H2O2O3 * nH2O3 - При нагревании разлагается:
4Fe(NO3)3 t→ 2Fe2O3 + 12NO2 + 3O2
Применение
- Применяется как коагулянт при очистке сточных вод.
- При окраске тканей и шерсти используют нитрат железа(III) как протраву.
- Нитрат железа(III) является катализатором для синтеза амида натрия из раствора натрия в аммиаке:
2NH3 + 2Na → 2NaNH2 + H2 - Некоторые глины, пропитанные нитратом железа(III), являются полезными окислителями в органическом синтезе.
- Используется ювелирами и кузнецами для протравки серебра и его сплавов.
