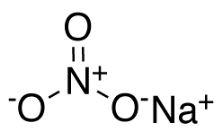
Структурная формула
 |
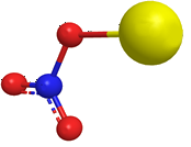 |
Истинная, эмпирическая, или брутто-формула: NNaO3
Химический состав Нитрата натрия
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| N | Азот | 14,007 | 1 | 16,5% |
| Na | Натрий | 22,99 | 1 | 27% |
| O | Кислород | 15,999 | 3 | 56,5% |
Молекулярная масса: 84,994
Нитрат натрия(азотноки́слый на́трий, натриевая селитра, чилийская селитра, натронная селитра) - натриевая соль азотной кислоты с формулой NaNO3. Бесцветные прозрачные кристаллы с ромбоэдрической или тригональной кристаллической решеткой без запаха. Вкус — резкий солёный. Применяется очень широко и является незаменимым в промышленности соединением.
Свойства
Физические свойства
Молекулярная масса — 85. Это бесцветные длинные кристаллы, плотностью 2,257 г/см3. tпл 308 °C, при t выше 380 °С разлагается.
Растворимость (г в 100 г) в:
- воде — 72,7 (0°С), 87,6 (20°С), 91,6 (25 °С), 114,1 (50 °C), 124,7 (60°С), 176,0 (100°С)
- жидком аммиаке — 127 (25 °С)
- гидразине — 100 (25 °С)
- этаноле — 0,036 (25 °С)
- метаноле — 0,41 (25 °С)
- пиридине — 0,35 (25 °С).
Химические свойства
ри нагревании до 380°С разлагается с выделением кислорода и нитрита натрия:
2NaNO3 → 2NaNO2+O2
Может вступать в реакции обмена с солями щелочных металлов. Благодаря меньшей, по сравнению с нитратом натрия, растворимости образующихся нитратов, равновесие указанных реакций смещено вправо:
NaNO3+KCl → KNO3+NaCl
NaNO3+RbI → RbNO3+NaI
Проявляет сильные окислительные свойства в твердом агрегатном состоянии и в расплавах.
В процессе разложения выделяет кислород, вследствие чего может взаимодействовать с неметаллами:
2NaNO3+S → 2NaNO2+SO2
2NaNO3+C → 2NaNO2+CO2
Реакция с серой проходит с большим выделением света и тепла, таким, что стеклянный сосуд, в котором проводится опыт, может лопнуть или расплавиться.
Его окислительные свойства близки к свойствам нитрата калия, поэтому он может использоваться аналогично в некоторых направлениях, например в пиротехнике.
Получение
В лаборатории нитрат натрия можно получить следующими способами:
- Взаимодействием металлического натрия или его оксида с азотной кислотой:
21Na + 26HNO3 → 21NaNO3 + NO+N2O + N2 + 13H2O
Na2O + 2HNO3 → 2NaNO3 + H2O - Гидроксида натрия или кислых солей натрия с азотной кислотой:
NaOH + HNO3 → NaNO3 + H2O
NaHCO3 + HNO3 → NaNO3 + CO2 +H2O
Также вместо азотной кислоты можно использовать нитрат аммония:
NaOH + NH4NO3 → NaNO3 + NH3 + H2O
NaHCO3 + NH4NO3 → NaNO3 + NH3 + CO2 + H2O - Взаимодействием нитрата серебра с пищевой солью (качественная реакция на ион Cl-): AgNO3 + NaCl → NaNO3 + AgCl
Применение
Применяется как удобрение; в пищевой, стекольной, металлообрабатывающей промышленности; для получения взрывчатых веществ, ракетного топлива и пиротехнических смесей для придания огню жёлтого цвета. Получается из природных залежей выщелачиванием горячей водой и кристаллизацией; абсорбцией раствором соды окислов азота; обменным разложением кальциевой или аммиачной селитры с сульфатом, хлоридом или карбонатом натрия.
